有关政策
海关发布最新口罩出口贸易指南,涉及资质通关申报及各国准入条件!
随着新冠病毒疫情的持续升级,口罩成为全球贸易的最新热点,随着全球其他国家因封城封国带来的生产影响,全球口罩需求正以同期百倍的量在增长!
中国成了全世界的口罩工厂!
那么,如何顺利地把中国大量优质的口罩买到世界各地,企业需要什么资质,出口有何限制,出口申报和通关以及其他国家对口罩有何要求.....
这些已经成了中国出口和物流企业最为关注也是最困扰的问题了!

据搜航网最新获悉,昨天(3月17日,海关总署通过官方渠道发布了以下最新最权威的口罩出口贸易指南,这无疑给广大涉口罩生产,出口和物流企业带来了极大的操作便利:
目录
一、出口通关提示
1.报关前提条件
2.出口资质
3.出口申报要求
4.出口退税
5.中美关税排除加征
6.快速通关保障
二、出口前准备
1.明确口罩分类
2.国内出口贸易企业需具备的资质和材料
3.国内出口口罩生产企业资质证明
4.内贸企业做出口需要取得的基本资质
三、各国口罩准入条件
1.美国
2.欧盟
3.日本
4.韩国
5.澳大利亚
四、各国注册、认证简要办理流程
1.美国NIOSH认证
2.美国FDA注册
3.欧盟CE注册
4.日本PMDA注册
5.韩国KFDA注册
6.澳大利亚TGA注册
五、各国口罩技术标准对比
六、各国口罩技术标准
出口通关提示:
报关前提条件:
收发货人注册编码(慈善机构可为临时编码),需办理无纸化通关法人卡
出口资质:
口罩出口对生产销售单位、境内发货人,除满足国内生产、市场流通资质需求外,中国海关无特殊资质要求。
出口申报要求:
1.商品归类:除特殊情况外,绝大部分口罩应归入税号63079000
2.检验检疫:口罩为非法检产品,申报时检验检疫项目无需填报。
根据我国政府与相关国家签订的政府间检验协议,对出口伊朗等少数几个国家的产品需按规定进行装运前检验。
3.关税征免:
如出口物资为贸易性质,征免性质申报一般征税,征免方式申报照章征税;
如为捐赠性质,境内发货人为贸易代理商、慈善机构等,征免性质可不填,征免方式申报全免。
4.禁限管理:目前商务部未对口罩设置贸易管制要求,中国海关也无针对防护物资的监管证件口岸验核要求。
5.申报规范:按照规范申报要求填写商品名称、成分含量;如物资非中国生产,原产国按照实际生产国填写。
出口退税:
口罩的出口退税率为13%
中美关税排除加征:
美国企业可申请排除口罩进口加征关税,但是目前只有少数企业获准豁免。详见美国贸易代表办公室网站https://ustr.gov/。
补充,根据美国贸易代表办公室2020年3月12日的最新公告,应为“无论美国进口商是否提交过排除请求,符合排除口罩产品说明的任何企业都可以享受免加征额外关税。”而不是仅少数企业准予豁免。

(USTR 2020年3月12日公告截图)
快速通关保障:
物资出口申报如遇单窗等系统故障,可联系现场海关采取应急方式处置,或者拨打海关12360热线进行咨询。
以下内容是根据国内外相关政府机构、专业网站、新闻报道收集整理而成,仅供参考。具体内容以相关管理部门、国外官方机构要求为准。
出口前准备:
明确口罩分类:
国外按照用途一般分为个人防护和医用两类口罩。

国内出口贸易企业需具备的资质和材料:
1.营业执照(经营范围有相关经营内容)。
2.企业生产许可证(生产企业)。
3.产品检验报告(生产企业)。
4.医疗器械注册证(非医用不需要)。
5.产品说明书(跟着产品提供)、标签(随附产品提供)。
6.产品批次/号(外包装)。
7.产品质量安全书或合格证(跟着产品提供)。
8.产品样品图片及外包装图片。
9.贸易公司须取得海关收发货人注册备案。
国内出口口罩生产企业资质证明:
生产个人防护或者工业用非医疗器械管理的普通口罩,有进出口权的企业,可自行直接出口。
生产属于医疗器械管理的口罩用于出口,中国海关不需要企业提供相关资质证明文件,但一般进口国会要求生产企业提供产品三证,以证明该进口的商品在中国已合法上市,具体如下:
1.营业执照(经营范围包含有医疗器械相关,非医疗级别的物品不需要)。
2.医疗器械产品备案证或者注册证。
3. 厂家检测报告。
生产企业有进出口权,可以自行出口,如没有进出口权,可以通过外贸代理进行出口销售。
内贸企业做出口需要取得的基本资质:
1. 向市场监管部门取得营业执照,增加经营范围“货物进出口、技术进出口、代理进出口”。
2. 向商务部门取得进出口权,可直接在商务部业务系统统一平台(http://iecms.mofcom.gov.cn/)申请,网上提交材料。
3. 向外汇管理局申请取得开设外汇账户许可。
4. 办理进出口货物收发货人海关注册登记。
各国口罩准入条件:
产品准入条件:
美国
必要资料:提单,箱单,发票。
个人防护口罩:
必须取得美国 NIOSH检测认证,即National Institute for Occupational Safety and Health美国国家职业安全卫生研究所认证。
医用口罩:
须取得美国FDA注册许可。

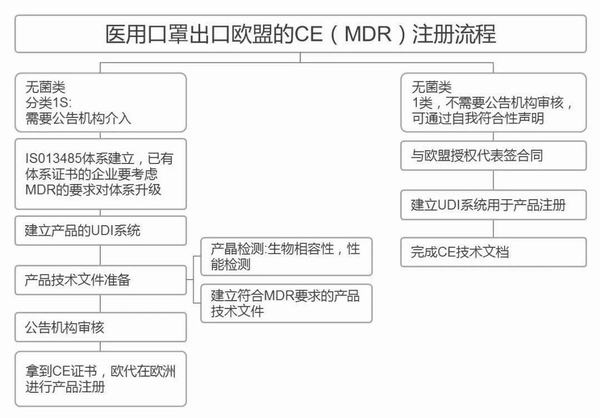
欧盟
必要资料:提单,箱单,发票。
个人防护口罩:
个人防护口罩的欧盟标准是EN149,按照标准将口罩分为FFP1/FFP2和FFP3三个类别。所有出口欧盟的口罩必须获得CE认证证书。CE认证是欧盟实行的强制性产品安全认证制度,目的是为了保障欧盟国家人民的生命财产安全。

医用口罩:
医用口罩对应的欧盟标准是EN14683。
产品在欧盟销售需要出具欧盟自由销售证书 Free Sale Certificate,有了CE标志并进行了相关指令中要求的欧盟注册后,中国的制造商出口欧盟不需要自由销售证书。
日本
必要资料:提单,箱单,发票,日本国外的制造商必须向PMDA注册制造商信息。
口罩包装要求:
包装上印有ウィルスカット(中文翻译:病毒拦截)99%的字样
PFE:0.1um微粒子颗粒过滤效率
BFE:细菌过滤率
VFE:病毒过滤率

口罩品质标准:
1. 医用防护口罩:符合中国GB 19083-2010 强制性标准,过滤效率≥95%(使用非油性颗粒物测试)。
2. N95口罩:美国NIOSH认证,非油性颗粒物过滤效率≥95%。
3. KN95口罩:符合中国GB 2626 强制性标准,非油性颗粒物过滤效率≥95%。
韩国
必要资料:提单,箱单,发票,韩国进口商营业执照。
个人防护口罩标准:
KF (Korean filter) 系列分为KF80、KF94、KF99


执行标准规范:
MFDS Notice No. 2015-69
韩国医疗器械准入的法规门槛,基本分类为I、II、III、IV类,持证为韩国公司(License holder),韩国收货人需要到韩国药监局Korea Pharmaceutical Traders Association. 提前备案进口资质(没有不行)网址:www.kpta.or.kr。
澳大利亚
必要资料:提单,箱单,发票。
须通过澳洲的TGA注册,符合标准规范:AS/NZS 1716:2012,此规范是澳大利亚和新西兰的呼吸保护装置标准。
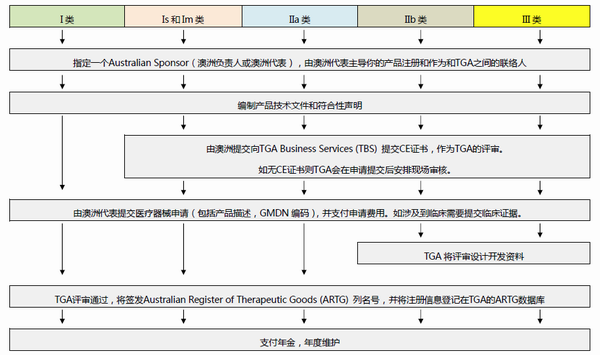
TGA 是Therapeutic Goods Administration的简写,全称是治疗商品管理局,它是澳大利亚的治疗商品(包括药物、医疗器械、基因科技和血液制品)的监督机构。澳大利亚对医疗器械分为I类,Is and Im, IIa, IIb, III类,产品的分类几乎和欧盟分类一致,如果产品已经获得CE标志,则产品类别可以按照CE分类。
各国注册、认证简要办理流程
美国NIOSH认证
需按照NIOSH的指南实施,企业需寄送样品至NIOSH实验室实施测试,同时提交技术性资料(包括质量体系部分资料)至NIOSH文审,只有文审和测试都通过,NIOSH才核发批文。
NIOSH将其认证的防颗粒物口罩分为9类,具体的测试则由NIOSH下属的NPPTL (National Personal Protective Technology Laboratory)实验室操作。主要测试指标包括呼气阻力测试、呼气阀泄漏测试、吸气阻力测试、过滤效率测试。
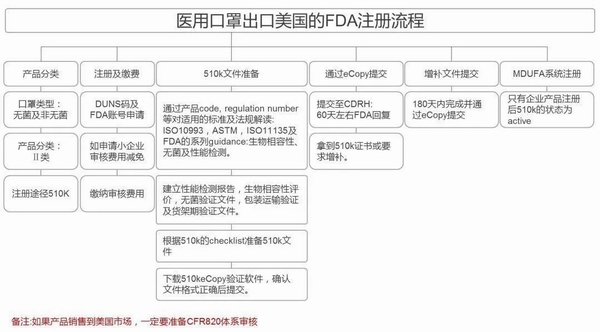
美国FDA注册
欧盟CE注册
日本PMDA注册
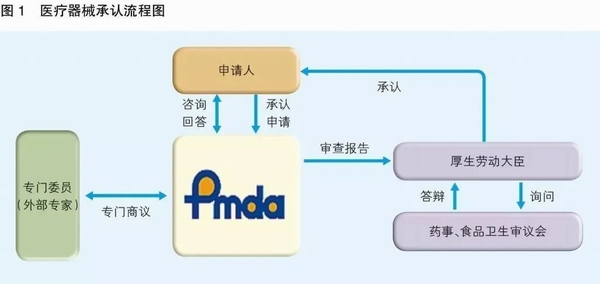
1. 准备阶段。确定产品分类(I,II特殊控制,II类控制,III,IV)和产品JMDN编码,选择MAH(日本持证方);
2. 制造商向PMDA注册工厂;
3. II类特殊控制产品向授权认证机构PCB申请QMS工厂审核,其他II类产品和III类IV类产品向PMDA申请QMS工厂审核,并获得QMS证书;
4. 申请Pre-Market Apporval证书,II类特殊控制由PCB发证,其他II类产品和III类IV类产品控制由MHLW(厚生劳动省)发证;
5. 支付申请费用;
6. 注册文件整改,注册批准;
7. 所有类别产品均需要MAH向RBHW(厚生省地区机构)进行进口通报注册后才能进口销售。
韩国KFDA注册
韩国卫生福利部(MinistryofHealthandWelfare,MHW),简称卫生部,主要负责管食品、药品、化妆品和医疗器械的管理,是最主要的卫生保健部门。依照《医疗器械法》,韩国卫生福利部下属的食品药品安全部负责对医疗器械的监管工作。KFDA注册流程为:
1. 确定产品分类(I,II,III,IV),选择KLH(韩国持证方);
2. II类产品需申请KGMP证书和接受现场审核,II类产品一般是授权的第三方审核员,并获得KGMP证书;
3. II类产品需要送样品到韩国MFDS授权的实验室进行韩国标准的测试;
4. 由KLH向MFDS(韩国食品药品安全部)提交技术文件(检测报告,KGMP证书等),进行注册审批;
5. 支付申请费用;
6. 注册文件整改,注册批准;
7. 指定韩国代理商和经销商,产品销售。
澳大利亚TGA注册
依据Australian Therapeutic Goods (Medical Devices) Regulations 2002,澳大利亚对医疗器械分为I类,Is and Im, IIa, IIb, III类,产品的分类几乎和欧盟分类一致,如果产品已经获得CE标志,则产品类别可以按照CE分类。如果已经获得欧盟公告机构(Notified Body)签发的CE证书,是可以被TGA认可的,并可以作为满足澳大利亚安全法规的重要注册资料。
各国口罩技术标准对比
(供生产企业参考)

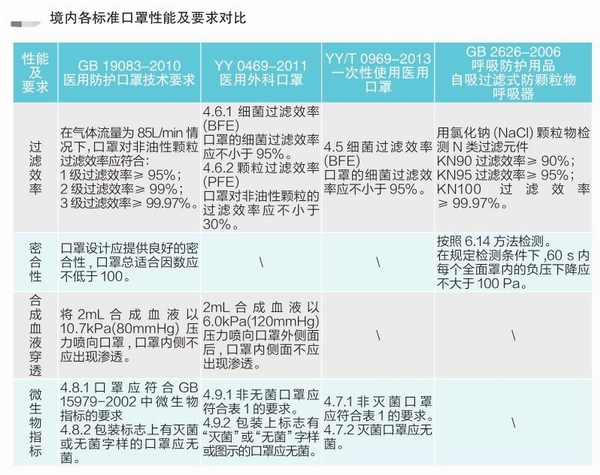
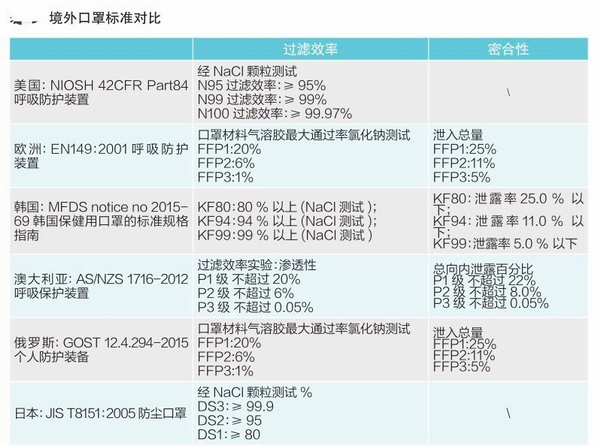
各国现行口罩技术标准
(供生产企业参考)
国际
ISO 22609:2004:传染试剂防护服.医疗面罩.防人造血渗透的试验方法(固定容积,水平注射),2004/12/3
欧盟
EN 136-1998:呼吸保护装置.全面罩.要求,试验,标记,1998/1/1
EN 140-1998+AC-1999:呼吸保护装置.半面罩和四分之一面罩.要求,试验和标记,1998/9/1
EN 143-2000 呼吸防护装置.微粒过滤器.要求,试验,标记。 现行 2000/2/1
EN 149-2001:呼吸防护装置.颗粒防护用过滤半面罩.要求,检验和标记,2001/4/1
EN 529-2005:呼吸保护装置.选择,使用,保养和维修的建议,2005
EN 12942-1998:呼吸保护器.带全面罩,半面罩和四分之一面罩的鼓风过滤装置.要求,检验,标识,1998
EN 14387-2004+A1-2008:呼吸保护装置.气体过滤器和组合过滤器.要求、测试、标记,2004/1/1
EN 14683-2019:医用口罩 要求和试验方法,2019/3/1
美国
ASTM F1862/F1862M-2017:医用口罩抗人工合成血渗透的标准试验方法(已知速度下固定体积的水平投影),2017
ASTM F2100-2019:医用口罩材料性能标准规范,2019
ASTM F2101-2019:用金黄色葡萄球菌生物气溶胶评价医用口罩材料的细菌过滤效率(BFE)的标准试验方法,2019
ASTM F2299/F2299M-2003(2017):用胶乳球测定医用面具材料粒子渗透性初始效率的标准试验方法,2003
澳大利亚
AS/NZS 1715:2009:呼吸保护设备的选择,使用和维护,2009/2/6
AS/NZS 1716:2012:呼吸保护装置,2012/2/13
日本
JIS T 8062:2010:预防传染性病原体的防护服.面罩.防止人造血浆渗透的试验方法(确定容量,平行注射),2010/5/25
JIS T 8159:2006:呼吸防护设备的选择、使用和维护指南,2006/4/25
JIS T 8159:2006:呼吸保护装置泄漏率试验方法,2006/2/20
韩国
KS M 6673-2008:防尘口罩,2008/2/22
KS K ISO 22609-2018:传染试剂防护服.医疗面罩.防人造血渗透的试验方法(固定容积、水平喷射),2018/11/14
*以上技术标准如有动态调整,以相关标准管理机构官方发布为准。

海关将继续发挥技术性贸易措施工作职能,持续关注和收集防护服、消毒用品等其他防疫物资出口国外准入条件和技术标准等技术性贸易措施,及时向外贸企业发布指南,助力企业复工复产,扩大出口。
(来源:搜航网)






.jpg)










